

Plant Communications:基因组和表型特征为一种全球入侵植物的广泛适应性提供新视角
互花米草具有较高的盐分泌效率,可以通过盐腺清除过度吸收的盐分(图1A)。这一特性使得米草属物种对海岸带生态系统的潮汐和盐胁迫具有较高的适应性。此外,相对于原产地而言,互花米草在入侵地往往进化出适应性表型性状。为了解析互花米草入侵的进化机制与遗传基础,该研究对互花米草进行了染色体水平的基因组组装。通过对互花米草的基因组进行系统解析发现,大部分蛋白质编码基因分布在染色体末端的端粒区域(图1B)。相比之下,Copia和Gypsy等重复序列则主要聚集在着丝粒区域。GC含量在所有染色体上都保持着相似的分布模式(44.95%)。另外,通过对互花米草、水稻、玉米、竹子、短柄草、香蕉、葡萄和拟南芥的蛋白质编码基因进行比较分析发现,在8个物种中共鉴定出28,028个基因家族,其中1,886个是互花米草特有的。在这些特有的基因家族中,分别有382个和8,728个基因经历了显著的收缩和扩张(图1C)。通过对互花米草特异性基因家族进行GO富集分析,发现了一些与适应相关的途径,比如耐盐性(海藻糖生物合成)、有性生殖、茎尖分生组织特性的维持等。其中,扩张基因家族功能主要涉及耐淹和耐盐性(即对活性氧的响应、细胞氧化还原稳态和钙介导的信号转导)、植物激素生物合成和调节(即赤霉素生物合成过程、茉莉酸和水杨酸介导的信号通路)、光形态建成(即光周期和远红光信号转导)、光合作用(即叶绿素结合和光系统II组装)等方面。收缩基因家族功能主要涉及侧根发育、细胞生长调控和去黄化等方面。
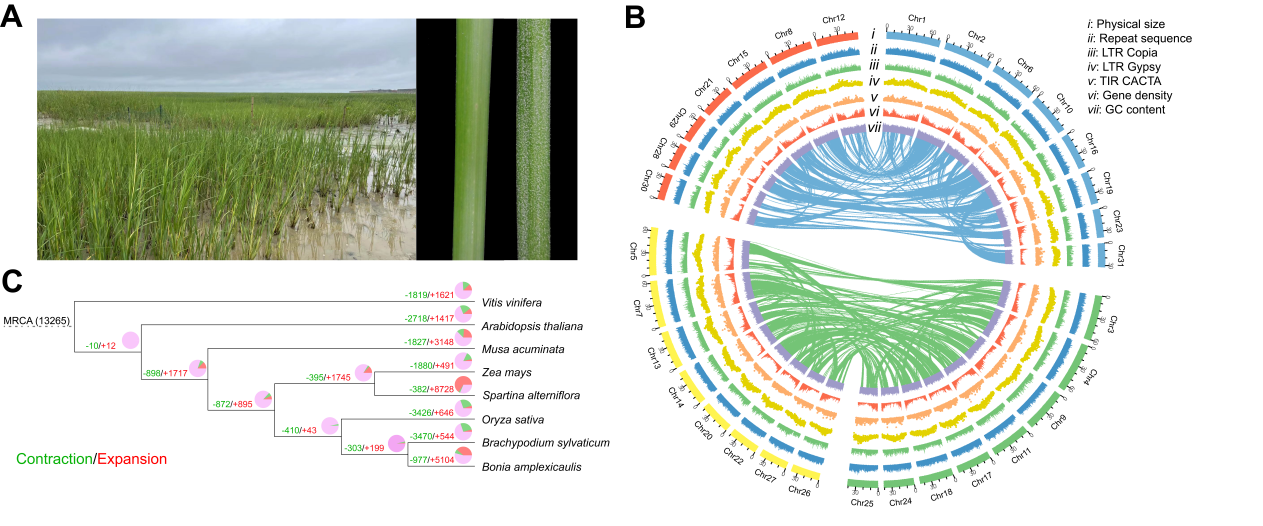
图1. 互花米草自然生境(A)、基因组特征(B)和基因家族进化(C)
(A)左图为北海(中国南方)互花米草的自然生境。右图显示了互花米草10%盐浓度下(右叶)与淡水(左叶)的盐分泌情况。右叶上的白点是分泌的盐分。(B)图从外到内分别是(i)染色体的物理大小;(ii)总重复序列的分布;(iii)Copia反转录转座子密度;(iv)Gypsy反转录转座子密度;(v)CACTA DNA转座子密度;(vi)基因密度;(vii)GC含量。(C)互花米草和其他7个物种基因家族的扩张(红色)和收缩(绿色)。分支上显示了扩张和收缩的基因家族数量。饼图中的红色、绿色和粉色分别表示扩张、收缩和平衡基因家族的比例。MRCA是8个被选物种最近的共同祖先。

图2. 原产地和入侵地互花米草种群的采样地点分布(A-C)和表型特征(D)
(A-C)从美国和中国收集的18个种群的地理位置。黄色、蓝色和绿色的点分别是原产地美国、入侵地中国高纬度和低纬度种群;种群名称在圆圈旁显示,红色箭头表示FZ种群的生长位置。(D)原产地美国和入侵地中国种群的营养和繁殖性状。黄色、蓝色和绿色分别代表原产地美国、入侵地中国高纬度和低纬度种群。
为了系统揭示互花米草的关键入侵性表型性状,该研究还对原产地美国和入侵地中国种群进行了同质园实验,以鉴定互花米草种群之间的营养和繁殖性状差异(图2)。研究结果显示,在这些表型性状中,中国的入侵种群与原产地美国种群在开花和生物量等适应性表型性状方面存在显著差异。比如,与美国源种群相比,中国种群的开花时间较长,具体表现在首次开花时间、盛花期和花期长度等性状上。另外,大多数中国种群也拥有更多的分蘖,更高的开花率,以及更大的株高和生物量(即地上和地下生物量)。值得注意的是,在中国沿海地区的入侵过程中,中国低纬度和高纬度种群在这些营养和繁殖性状上也进化出了差异表型。例如,与高纬度种群相比,中国低纬度种群在营养性状上具有更高的适合度,包括更大的株高和地上/地下生物量;而中国高纬度种群的开花时间相比于低纬度种群更早。
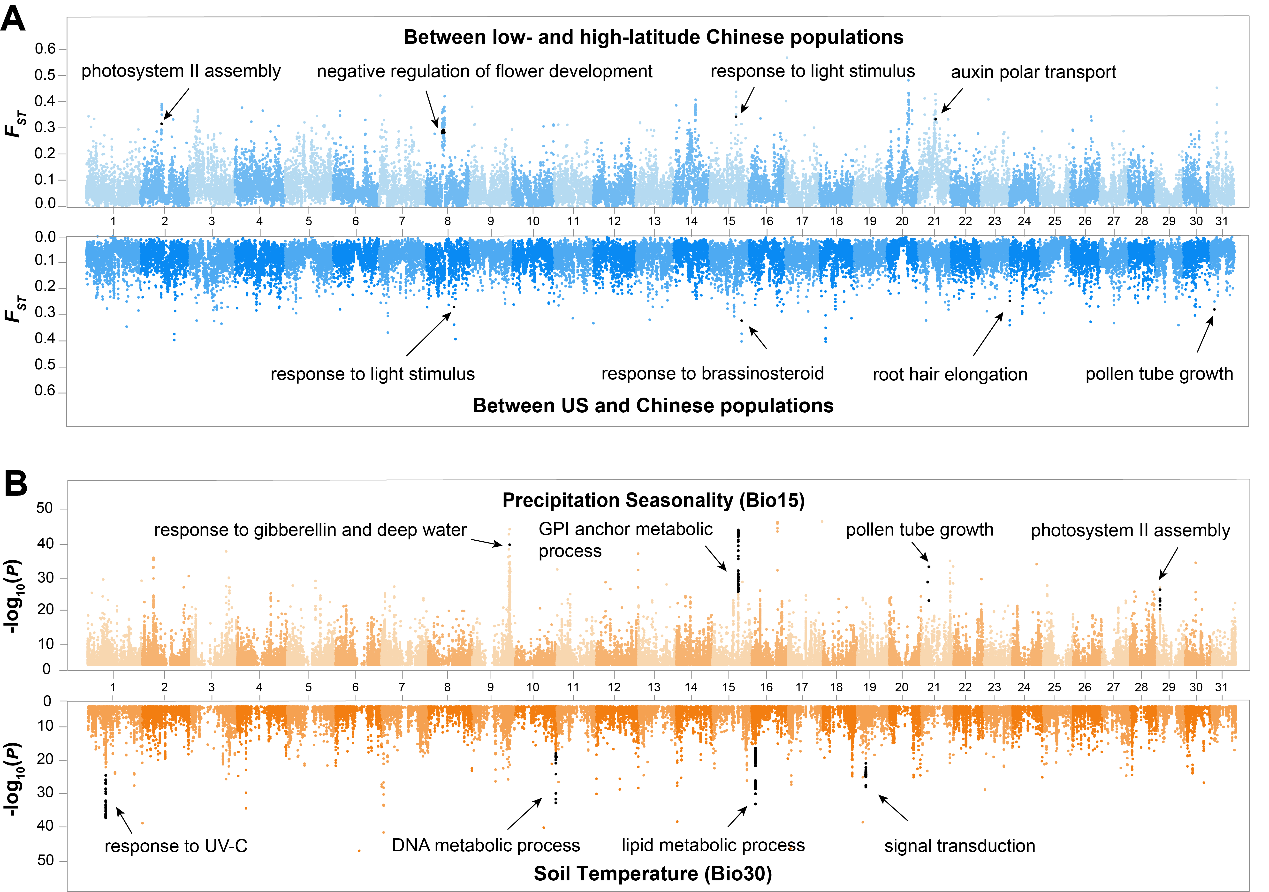
图3. 原产地和入侵地互花米草种群的遗传分化系数(A)及与环境因子的关联分析(B)
(A)在50kb滑动窗口下,中国低纬度和高纬度种群之间(上图)以及美国与所有中国种群(下图)之间的遗传分化系数。X轴和Y轴上的数字分别为染色体编号和FST值。(B)与季节性降水(BIO15)(上图)和土壤温度(BIO30)(下图)遗传变异相关的曼哈顿图。X轴和Y轴分别为染色体编号及与环境因子相关snp的显著性。候选基因的功能富集通路用黑色箭头表示。
为了明确互花米草适应性表型性状形成的分子基础,该研究采用了三种不同的研究策略来鉴定受到选择的基因。首先,计算了原产地、入侵地低纬度和高纬度种群之间成对的遗传分化系数(FST)。结果显示,尽管所有的中国种群都来自相同的美国源种群,但低纬度和高纬度种群之间以及中国种群和美国源种群之间都进化出了高分化的基因组区域(图3A)。这些高分化的基因主要与植物光合作用(即光合作用的调控)、光形态建成(即光刺激响应)、植物生长和发育(即对生长素的反应、调节花粉管生长、侧根和花的发育)等相关。其次,进行了全基因组选择扫描分析,确定了在原产地和入侵地种群中受到选择的基因组区域。与高分化区域的分布模式类似,大多数选择性扫描区域都是特定于某些种群的,说明了互花米草在入侵过程中出现了本地适应(local adaptation)。例如,在北方种群TS中,31条染色体中有23条包含选择性扫描区域。这些区域内的蛋白质编码基因在功能上与冷适应、根系发育、光形态建成以及对防御和盐胁迫的响应相关。同样,在低纬度种群BH中发现的候选基因在功能上主要与光合作用(即叶绿素和类胡萝卜素的生物合成)、光形态建成和植物生长发育(即对生长素的响应和对花发育的调控)相关。相比之下,虽然美国种群中也存在选择性扫描区域,但候选基因在上述功能通路中并没有显著富集。最后,进行了环境因子关联分析以确定是否有遗传变异与环境因子相关。结果显示,与温度和降水相关的环境因子与一些遗传变异相关,如最热月的最高温度(BIO5)、季节性降水(BIO15)、土壤湿度(BIO24)和土壤温度(BIO30)等(图3B)。这些受到选择的候选基因主要在光合作用、光形态建成、根和花器官的发育等重要过程中显著富集。鉴于这些环境因子在中国沿海地区逐渐变化,这些因素很可能是在入侵过程中形成基因组结构的潜在决定因素。
综上所述,互花米草是海岸带生态系统中入侵性最强的外来物种之一,已对潮间带光滩和盐沼产生了严重的生态后果。该研究表明,中国低纬度和高纬度种群在沿海有意引种与自然扩散过程中均进化出了入侵性性状。同时基于基因组和转录组数据的综合分析进一步揭示了低纬度和高纬度种群不同的进化轨迹。这些表型和基因组特征表明,资源优先分配到生长—防御权衡和高基因组可塑性是入侵成功的潜在机制。此外,在该研究中发现的与抗逆性相关的候选基因对其他谷类作物的育种改良研究具有重要的参考价值。
复旦大学生命科学学院博士生郝燕为本论文第一作者,复旦大学/云南大学李博教授、中山大学李霖锋教授和兰州大学吴纪华教授为共同通讯作者。复旦大学杨继教授、鞠瑞亭教授、博士生郭耀霖、李天杨,中山大学博士后王新风,法国雷恩大学Malika L. Ainouche教授、Armel Salmon教授为论文共同作者。该研究受到国家重点研发计划(2022YFC2601100)、国家自然科学基金(32030067、31970235、32171661、31961133028)等项目资助。




